イムセラ製品情報
薬物動態
血中濃度
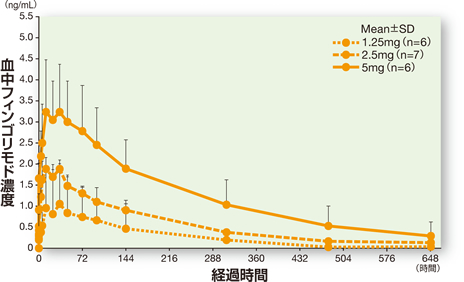
1 単回投与での検討(健康成人)1,2)
健康成人(19例)にイムセラ1.25、2.5、5mgを単回経口投与したとき、投与16時間後(中央値)に最高血中薬物濃度(Cmax)に到達し、消失半減期は5.8~7.6日間であった。
| 対 象 | 日本人健康成人19例(イムセラ1.25mg群6例、2.5mg群7例、5mg群6例) |
|---|---|
| 方 法 | イムセラ1.25、2.5、5mgを単回経口投与 |
血中濃度の推移(単回投与:健康成人)
薬物動態パラメータ
| 測定物質 | 対象者 | Tmax ※(h) |
Cmax (ng/mL) |
AUClast (ng・h/mL) |
T1/2 (days) |
|---|---|---|---|---|---|
| 未変化体 | 1.25mg (n=6) |
16 (16~36) |
1.1 ±0.2 |
168 ±27 |
5.9 ±2.4 |
| 2.5mg (n=7) |
16 (16~36) |
1.9 ±0.3 |
353 ±87 |
5.8 ±1.5 |
|
| 5mg (n=6) |
16 (12~36) |
3.5 ±1.2 |
823 ±292 |
7.6 ±3.4 |
|
| リン酸化体 | 1.25mg (n=5) |
6 (6~12) |
1.3 ±0.2 |
8 ±5 |
- |
| 2.5mg (n=7) |
12 (6~12) |
2.2 ±0.3 |
37 ±16 |
- | |
| 5mg (n=6) |
12 (6~16) |
3.6 ±1.1 |
158 ±76 |
- |
Mean±SD ※:中央値(最小値~最大値)
1)Kovarik, J.M. et al.: J. Clin. Pharmacol. Ther. 45, 98(2007)
2)田辺ファーマ(株):日本人及び白人健康成人の薬物動態に関わる資料(A2304試験)(承認時評価資料)
【用法・用量】通常、成人にはフィンゴリモドとして1日1回0.5mgを経口投与する。
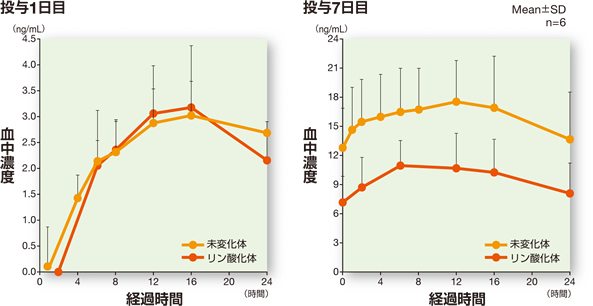
2 反復投与での検討
1)健康成人3,4)
健康成人(6例)にイムセラ5mgを1日1回7日間反復経口投与したときの、未変化体及び活性本体であるリン酸化体の投与1日目及び7日目の薬物動態パラメータは下表のとおりであった。未変化体の消失半減期は7.9日間であり、単回投与と同様であった。
血中濃度の推移(反復投与:健康成人)
薬物動態パラメータ
| 投与量 | Tmax ※(h) |
Cmax (ng/mL) |
AUCtau (ng・h/mL) |
T1/2 (days) |
|
|---|---|---|---|---|---|
| 投与1日目 | 未変化体 | 14 (6~16) |
3.1 ±0.8 |
54 ±12 |
- |
| リン酸化体 | 14 (6~16) |
3.7 ±1.1 |
52 ±14 |
- | |
| 投与7日目 | 未変化体 | 12 (6~16) |
18.2 ±4.8 |
382 ±106 |
7.9 ±2.0 |
| リン酸化体 | 9 (6~16) |
11.3 ±3.5 |
236 ±76 |
6.0 ±2.4 |
Mean±SD ※:中央値(最小値~最大値)n=6
3)Kovarik, J.M. et al.: J. Clin. Pharmacol. Ther. 45, 98(2007)
4)田辺ファーマ(株):日本人及び白人健康成人の薬物動態に関わる資料(A2304試験)(承認時評価資料)
2 多発性硬化症患者5)
多発性硬化症患者(108例)にイムセラ0.5又は1.25mgを1日1回6ヵ月間反復経口投与したとき、薬物濃度はいずれも投与2ヵ月後までに定常状態に到達し、定常状態における未変化体及びリン酸化体の血中濃度は下表のとおりであった。
| 対 象 | 再発性多発性硬化症患者108例(イムセラ0.5mg群54例、1.25mg群54例) |
|---|---|
| 方 法 | イムセラ0.5又は1.25mgを1日1回6ヵ月間反復経口投与 |
血中トラフ濃度の推移(反復投与:多発性硬化症患者)

イムセラ0.5又は1.25mgを6ヵ月間反復経口投与したときの未変化体及びリン酸化体の血中濃度
| 未変化体 | リン酸化体 | |||
|---|---|---|---|---|
| 評価時間 | 0.5mg群 | 1.25mg群 | 0.5mg群 | 1.25mg群 |
| 15日後 | 2.64±1.01 (54) |
6.76±2.59 (54) |
1.37±0.61 (54) |
3.60±1.54 (54) |
| 1ヵ月後 | 3.15±1.30 (54) |
8.01±2.55 (51) |
1.69±0.87 (54) |
4.32±1.52 (51) |
| 2ヵ月後 | 2.96±1.23 (52) |
8.77±3.08 (50) |
1.57±0.81 (51) |
4.88±1.93 (50) |
| 3ヵ月後 | 3.19±1.31 (51) |
8.61±3.02 (49) |
1.70±0.86 (50) |
4.80±1.92 (49) |
| 6ヵ月後 | 3.50±1.44 (47) |
8.92±3.55 (48) |
1.82±0.81 (47) |
4.84±2.09 (48) |
ng/mL ( )内は症例数
5)田辺ファーマ(株):日本人多発性硬化症患者での薬物動態に関わる資料(D1201試験)(承認時評価資料)
