適正使用ガイド
注意すべき副作用とその対策
感染症
感染症の発現状況
- イムセラの薬理作用(末梢血中のリンパ球減少作用)により、本剤投与中に細菌、真菌、ウイルス等による感染症が現れることがあります。
- 本剤の国内臨床試験における感染症の発現率は45.3%(73/161例)であり、主なものは鼻咽頭炎(28.0%)、咽頭炎(5.0%)、膀胱炎(3.1%)、気管支炎(1.9%)などでした。
- なお、海外臨床試験では、本剤1.25mg※群で播種性帯状疱疹、ヘルペス脳炎による死亡例が報告されています。
- 国内および海外の臨床試験でともに、リンパ球数<200/mm3を示した症例が、イムセラ投与群でプラセボ群よりも高率に認められました(表)。
- 本剤を単回経口投与したとき、投与16時間後に最高血中濃度に到達し、血中消失半減期は6~9日間と長く、投与中止後の本剤の血中からの消失には最長で2ヵ月かかる場合があり、その間はリンパ球数減少などの薬力学的効果も持続するため、感染症の発現等に注意してください。なお、通常、リンパ球数は投与中止後1~2ヵ月以内に正常範囲内に回復します。リンパ球数は、投与開始15日後までにベースライン値から約70%減少し、その減少作用は投与期間を通して持続することが示されています(図)。
表 試験期間中にリンパ球数<200/mm3を示した症例および投与中断・中止〔国内第Ⅱ相試験、海外第Ⅲ相試験〕
国内第Ⅱ相試験
| イムセラ | プラセボ群 (n=57) |
||
|---|---|---|---|
| 0.5mg 群 (n=57) |
1.25mg※群 (n=54) |
||
| リンパ球数<200/mm3 | 5例(8.8%) | 11例(20.4%) | 0例(0%) |
| 上記該当例のうち、 | |||
| 治験薬の投与中断 | 1例(1.8%) | 4例(7.4%) | 0例(0%) |
| 治験薬の投与中止 | 1例(1.8%) | 1例(1.9%) | 0例(0%) |
[社内資料]
海外第Ⅲ相試験 海外データ
| イムセラ | プラセボ群 (n=418) |
||
|---|---|---|---|
| 0.5mg 群 (n=425) |
1.25mg※群 (n=429) |
||
| リンパ球数<200/mm3 | 75例(17.6%) | 127例(29.6%) | 0例(0%) |
| 上記該当例のうち、 | |||
| 治験薬の投与中断 | 38例(8.9%) | 65例(15.2%) | 0例(0%) |
| 治験薬の投与中止 | 12例(2.8%) | 32例(7.5%) | 0例(0%) |
[社内資料]
(注)イムセラは末梢循環血中のリンパ球数を減少させる作用を有するため、中央検査施設で測定した白血球数、好中球数およびリンパ球数の結果は、盲検性確保の観点から治験担当医師には知らせず、リンパ球数<200/mm3を示した場合にのみ通知された。
リンパ球数<200/mm3を示した症例のうち、治験薬の投与を1日でも中断したことがある症例、ならびに中止した症例の割合を提示した。なお、中断理由、中止理由にかかわらず集計した。
国内第Ⅱ相試験
- 【対象】
- 日本人再発性多発性硬化症患者168例 (年齢:18~60歳、EDSS:0~6.0、過去1年間に1回以上または過去2年間に2回以上の再発を経験またはスクリーニング期のGd造影T1強調病巣が1つ以上、試験薬割り付け前30日間に再発を経験していない、スクリーニング期のT2病巣が1つ以上)
- 【方法】
- プラセボ対照・無作為化・二重盲検比較試験。対象患者を無作為に3群に割り付け、イムセラ0.5mg、1.25mg※、またはプラセボの1日1回経口投与を6ヵ月間行い、イムセラの有用性をプラセボと比較検討した。
- 【感染症に関する除外基準】
- 白血球数が3,500/mm3未満、またはリンパ球数が800/mm3未満(本試験には感染症ならびにリンパ球減少のリスクを有する患者は含まれていない)
海外第Ⅲ相試験(FREEDOMS試験)
- 【対象】
- 再発寛解型多発性硬化症患者1,272例(年齢:18~55歳、EDSS:0~5.5、過去1年間に1回以上または過去2年間に2回以上の再発を経験、試験薬割り付け前30日間に再発を経験していないまたはステロイド治療を受けていない)
- 【方法】
- プラセボ対照・無作為化・二重盲検比較試験。対象患者を無作為に3群に割り付け、イムセラ0.5mg、1.25mg※、またはプラセボの1日1回経口投与を2年間行い、イムセラの長期有用性をプラセボと比較検討した。
- 【感染症に関する除外基準】
- 白血球数が3,500/mm3未満、またはリンパ球数が800/mm3未満(本試験には感染症ならびにリンパ球減少のリスクを有する患者は含まれていない)
※:本邦におけるイムセラの用法・用量は、1日1回0.5mg
図 6ヵ月間のリンパ球数の推移〔国内第Ⅱ相試験〕
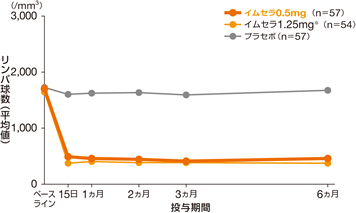
国内第Ⅱ相試験
- 【対象】
- 日本人再発性多発性硬化症患者168例(年齢:18~60歳、EDSS:0~6.0、過去1年間に1回以上または過去2年間に2回以上の再発を経験またはスクリーニング期のGd造影T1強調病巣が1つ以上、試験薬割り付け前30日間に再発を経験していない、スクリーニング期のT2病巣が1つ以上)
- 【方法】
- プラセボ対照・無作為化・二重盲検比較試験。対象患者を無作為に3群に割り付け、イムセラ0.5mg、1.25mg※、またはプラセボの1日1回経口投与を6ヵ月間行い、イムセラの有用性をプラセボと比較検討した。
- 【感染症に関する除外基準】
- 白血球数が3,500/mm3未満、またはリンパ球数が800/mm3未満(本試験には感染症ならびにリンパ球減少のリスクを有する患者は含まれていない)
※:本邦におけるイムセラの用法・用量は、1日1回0.5mg
[社内資料]
感染症で死亡に至った症例
- イムセラの海外臨床試験において、2,315例中12例で重篤なヘルペスウイルス感染が認められました。
- 12例中、8例で局所的な帯状疱疹ウイルス感染、1例で局所的な単純ヘルペスウイルス感染、3例で播種性ヘルペスウイルス感染を発現しました。
- このうち、播種性ヘルペスウイルス感染(播種性帯状疱疹、ヘルペス脳炎)を発現した計2例が死亡しました。
- 海外臨床試験で確認された死亡例2例 [海外データ]
-
20代、男性 再発寛解型多発性硬化症患者(病歴2年)
- 【経過および処置】
- イムセラ1.25mg※治療に加え、多発性硬化症再発のためにステロイドパルス療法を実施、及び経口ステロイドを服用した状況で「水痘・帯状疱疹ウイルス」(VZV)に初感染し、その後急激に重症化して死亡。
- 【V Z V 既往歴】
- 水痘感染症の既往歴なし。VZVの予防接種歴なし。VZVのIgG抗体検査陰性。
- 【V Z V 感染経路】
- 水痘患者が報告されていた育児・保育園センターに勤務していたために感染したと推定される。
「ヘルペス脳炎」により死亡した1例[海外症例]
- 【経過および処置】
- イムセラ1.25mg※治療中、数日間にわたる断続的な高熱及び発作がみられ、多発性硬化症再発の疑いによりステロイドパルス療法を実施。初期症状から1週間後に「ヘルペス脳炎」と診断され、アシクロビル投与と脳浮腫治療を開始したものの、脳機能は改善せず死亡。
※:本邦におけるイムセラの用法・用量は、1日1回0.5mg
[社内資料]
進行性多巣性白質脳症(PML)に至った症例
- 海外でナタリズマブ(遺伝子組換え)製剤の治療歴のない患者において、イムセラとの関連性が否定できないPMLが報告されました。
PMLが疑われた40代男性の多発性硬化症患者1例[海外症例]
【経過および処置】
- 投与1年前
- 多発性硬化症(MS)と診断。インターフェロン(IFN)β-1aで約10ヵ月間治療。ナタリズマブ及び免疫系に影響を与える薬剤の治療歴はなし。
- 投与開始日
- IFNβ-1a中止後、イムセラ0.5mgの投与を開始。
- 投与4年目
- 定期的なMRI画像検査により非典型的な新規MS病変を認め、PMLが疑われたため、本剤の投与を中止。脳脊髄液検査を行ったところ、JCウイルス(JCV)DNAのPCRが43コピー/mL、JCV-ASI(Antibody Specificity Index)が23(生理学的範囲は1.5まで)であったことから、PMLの可能性が高いと診断された。PMLの臨床症状及び徴候は認められていない。
- 【併用薬】
- コルチコステロイド(短期使用)
PMLと診断された50代男性の多発性硬化症患者1例[海外症例]
【経過および処置】
- 投与約11年前
- 多発性硬化症と診断。IFNβ-1bで約11年間治療。ナタリズマブの治療歴はなし。
- 投与開始日
- IFNβ-1bからイムセラに切り替えて、投与開始。
- 投与2年半目
- 3週間にわたる歩行・運動障害の進行及び認知障害のため、救急外来を受診。注意障害、アパシー、常同性運動障害及び右痙攣性不全片麻痺等の症状も認められたため、 PMLを疑い入院。本剤の投与を中止。MRI画像検査ではPML病巣を示唆するMass effectやGd造影病変を伴わないT2強調病変が両半球に認められ、脳脊髄液検査ではJCV DNA陽性となったため、報告医師によりPMLと診断された。
- 【併用薬】
- メサラジン(潰瘍性大腸炎)
[社内資料]
- リスクを軽減するための注意事項
-
- 【警告】より
- ステロイドパルス療法が複数回施行された症例で、播種性ヘルペスウイルス感染による死亡例、およびEpstein-Barrウイルス感染によると考えられる悪性リンパ腫およびリンパ増殖性疾患等による死亡例が認められていることから、多発性硬化症の再発と思われる症状がみられた場合、およびステロイドパルス療法を行う場合には、感染症等に由来する症状でないかを慎重に鑑別した上で治療してください。
- 【禁忌】より
- 重篤な感染症のある患者に対しては、イムセラを投与しないでください。
- リンパ球数について
-
- 本剤投与開始前に血液検査(血球数算定等)を行うとともに、投与中には定期的(投与開始15日後、1、2、3、6ヵ月後、それ以降は3ヵ月ごと等)*に血液検査を実施してください。
- リンパ球数が200/mm3を下回った場合には、2週後を目処に再検査を実施し、連続して200/mm3未満であった場合には、原則として投与を中断し、リンパ球数が回復するまで患者の状態を慎重に観察するとともに、感染症の兆候に注意を払うなど、適切な処置を行ってください。
- 投与再開については、リンパ球数が600/mm3以上まで回復することを目安とし、治療上の有益性と危険性を慎重に評価した上で判断してください。
- 水痘・帯状疱疹について
-
- 本剤投与中に水痘または帯状疱疹に初感染すると重症化するおそれがあるため、本剤投与開始前に水痘または帯状疱疹の既往や予防接種の有無を確認し、必要に応じてワクチン接種を考慮してください。
- 接種する場合はワクチンの効果が十分に得られるまで、本剤投与開始を延期してください。
- 感染症の発現時について
-
- 患者に対し、感染症状(発熱、けん怠感等)が現れた場合には直ちに主治医に連絡するよう指導してください。
- 治療中に感染症が疑われる症状が認められた場合には、本剤の投与中断を考慮するとともに、早期に適切な処置を行ってください。
- 重篤な感染症が発現した場合には本剤の投与を中断し、適切な処置を行ってください。投与再開については、感染症の回復を確認し、治療上の有益性と危険性を慎重に評価した上で判断してください。
- 本剤投与中止後、リンパ球数が回復するには最長2ヵ月かかる場合があるため、その間は感染症に対し注意が必要です。
- 【慎重投与】について
- 以下の患者に対しては慎重に投与してください。
- 感染症のある患者、感染症が疑われる患者
- 水痘または帯状疱疹の既往歴がなく、予防接種を受けていない患者
- 易感染性の状態にある患者
- 【併用禁忌】、【併用注意】について
-
- 生ワクチン(乾燥弱毒生麻しんワクチン、乾燥弱毒生風しんワクチン、経口生ポリオワクチン、乾燥BCG等)とは併用しないでください。(【併用禁忌】本剤は免疫系に抑制的に作用するため、生ワクチンを接種すると増殖し、病原性を現すおそれがある)
- 不活化ワクチンや抗腫瘍剤、免疫抑制剤を本剤と併用する場合は注意してください。(【併用注意】本剤は免疫系に抑制的に作用するため)
*:〔参考〕国内第Ⅱ相試験(6ヵ月)のプロトコールより
