適正使用ガイド
注意すべき副作用とその対策
黄斑浮腫
黄斑浮腫の発現状況
- 無症候性も含め、特にイムセラ投与初期には黄斑浮腫が現れることがあります。
- 海外臨床試験における黄斑浮腫の発現率はイムセラ0.5mg群で0.2%(2/854例)、1.25mg※群で1.4%(12/849例)でした。多くは投与開始3~4ヵ月後までに認められました(図)。
- なお、国内臨床試験では、イムセラ0.5mg群の1例のみで黄斑浮腫が報告(投与27ヵ月後)されましたが、DSMB§の網膜専門医による画像判定では、黄斑浮腫は否定されました。
- 黄斑浮腫の初期は視覚症状を伴わない場合が多く、本剤投与後にみられた黄斑浮腫の発現例の多くは無症候性でした。なお、一部の発現例で、初期に霧視(霧がかって見える)または視力低下が認められました。
- 糖尿病の患者またはブドウ膜炎の既往歴のある患者では、黄斑浮腫が発現するリスクが増大します。
- シクロスポリンおよび経口ステロイド併用下におけるイムセラ2.5mg※および5mg※を用いた腎移植注)の臨床試験の結果、非糖尿病患者における黄斑浮腫発現率はイムセラ群4%、ミコフェノール酸モフェチル(MMF)群2%であったのに対し、糖尿病患者ではイムセラ群30%、MMF群15%と、イムセラ群のほうがMMF群よりも2倍高く、そして糖尿病患者で高率に発現していました。
- 多発性硬化症患者を対象としたイムセラの海外臨床試験の結果、ブドウ膜炎未既往例では黄斑浮腫発現率が0.6%であったのに対し、ブドウ膜炎既往例では約20%と高率に発現していました。
注)本邦におけるイムセラの効能・効果は、「多発性硬化症の再発予防及び身体的障害の進行抑制」§ DSMB:Data and Safety Monitoring Board( データおよび安全性モニタリング委員会)
図 黄斑浮腫の累積発現率の推移〔海外第Ⅲ相試験併合解析〕海外データ
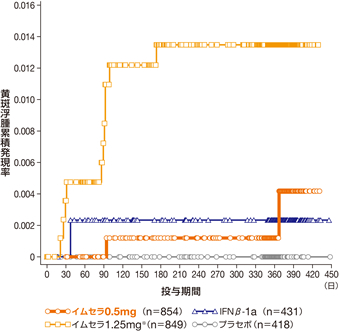
海外第Ⅲ相試験併合解析
海外第Ⅲ相試験の2試験(FREEDOMS試験1)、TRANSFORMS試験2))を併合して「1年間長期投与データ」として解析し、下記治療群を比較検討。
- イムセラ0.5mg :854例
- イムセラ1.25mg※:849例
- インターフェロン(IFN)β-1a 30μg筋注:431例
- プラセボ:418例
FREEDOMS試験
- 【対象】
- 再発寛解型多発性硬化症患者1,272例(年齢:18~55歳、EDSS:0~5.5、過去1年間に1回以上または過去2年間に2回以上の再発を経験、試験薬割り付け前30日間に再発を経験していないまたはステロイド治療を受けていない)
- 【方法】
- プラセボ対照・無作為化・二重盲検比較試験。対象患者を無作為に3群に割り付け、イムセラ0.5mg、1.25mg※、またはプラセボの1日1回経口投与を2年間行い、イムセラの長期有用性をプラセボと比較検討した。
TRANSFORMS試験
- 【対象】
- 再発寛解型多発性硬化症患者1,292例(年齢:18~55歳、EDSS:0~5.5、過去1年間に1回以上または過去2年間に2回以上の再発を経験、試験薬割り付け前30日間に再発を経験していないまたはステロイド治療を受けていない)
- 【方法】
- 実薬対照・無作為化・二重盲検比較試験。対象患者を無作為に3群に割り付け、イムセラ0.5mg、1.25mg※の1日1回経口投与、またはIFNβ-1a 30μgの週1回筋肉内注射を1年間行い、イムセラの長期有用性をIFNβ-1aと比較検討した。
※:本邦におけるイムセラの用法・用量は、1日1回0.5mg
[社内資料]
1)Kappos L et al: N Engl J Med 362(5): 387-401, 2010
2)Cohen JA et al: N Engl J Med 362(5): 402-415, 2010
- リスクを軽減するための注意事項
-
- 【警告】より ―眼科医との連携について―
-
- イムセラの投与により、黄斑浮腫等の重篤な眼疾患が発現することがあるので、十分に対応できる眼科医と連携がとれる場合にのみ使用してください。眼科医と連携が可能であることが、本剤を使用するための「施設要件」です。
- 患者が、本剤の連携が確認できていないかかりつけ眼科医への受診を希望する場合は、処方予定医師は弊社MR(医薬情報担当者) に当該かかりつけ眼科医を連絡してください。
-
- (注)医療施設の「施設要件」
-
- ①本剤の適正使用情報を伝達できている施設であること
- ②多発性硬化症(MS)の診断が可能で、十分なMS治療経験を有する医師であり、原則として日本神経学会、日本神経免疫学会、日本神経治療学会のいずれかの学会に所属する医師が在籍している施設であること
- ③循環器を専門とする医師と連携するなど、適切な処置が行える管理下での投与開始並びに心電図測定を含む観察が可能な診療体制が取られていること。
- ④本剤の重篤な副作用(感染症等)へ対応できる診療体制が取られている施設であること
- ⑤眼科医との連携を取ることが可能な施設であること
- ⑥全例調査への理解と協力が得られた施設であること
- 眼科学的検査の実施について
-
- 黄斑浮腫の初期は視覚症状を伴わない場合があるため、薬剤誘発性の黄斑浮腫を早期発見するためにも、本剤投与開始3~4ヵ月後に眼底検査を含む眼科学的検査を実施し*1、その結果を入手してください。
- 患者が視覚障害を訴えた場合にも、眼科学的検査を実施してください。
- 糖尿病の患者またはブドウ膜炎の既往歴のある患者では黄斑浮腫が発現するリスクが増大するため、本剤投与開始前に眼科学的検査を実施し、投与中にも定期的(投与開始1、3、6ヵ月後、それ以降は6ヵ月ごと等)*2に検査を実施してください。
- 黄斑浮腫が確認された場合
-
- 黄斑浮腫が確認された場合には本剤の投与を中断し、適切な処置を行ってください。
- 回復後の投与再開については、治療上の有益性と危険性を慎重に評価した上でご判断ください。
- 【慎重投与】について
- 黄斑浮腫のある患者、糖尿病の患者、ブドウ膜炎の既往歴のある患者に対しては、慎重に投与してください。
*1:投与開始前と投与3ヶ月以内の検査が推奨されます
*2:〔参考〕国内第Ⅱ相試験(6ヵ月)のプロトコールより
【参考】イムセラの臨床試験における「眼科学的検査」の内容
- 眼科病歴
- 矯正視力
- 散瞳眼底検査
散瞳薬を点眼して瞳孔を広げ、瞳孔の奥にある眼底、網膜、視神経、血管などを調べる検査。 - 光干渉断層計(OCT)検査による中心窩網膜厚測定
OCT検査は、近赤外線を眼底にあてることで、網膜の断面像を得ることのできる検査法。患者自身にはほとんど負担がなく、黄斑浮腫や加齢黄斑変性症などの診断に用いられている。
